
新结构显示了病毒包裹的蛋白质如何劫持细胞导体蛋白并促进病毒传播; 研究结果可以加快药物设计以防止严重影响 新冠肺炎.
美国能源部 (DOE) 布鲁克海文国家实验室的科学家们发表了第一个详细的原子级模型 SARS-CoV-2 一种“包膜”蛋白质,它与维持肺内壁所必需的人类蛋白质结合。 该模型展示了两种蛋白质如何相互作用,刚刚发表在该杂志上 自然联系,有助于解释病毒如何导致广泛的肺损伤并从肺部逃逸以感染特别脆弱的 COVID-19 患者的其他器官。 这些发现可能会加速寻找能够预防该疾病最严重影响的药物。
“通过获得蛋白质相互作用的原子水平的细节,我们可以解释为什么会发生损害,并寻找可以专门阻止这些相互作用的抑制剂,”该研究的主要作者、布鲁克海文实验室的结构生物学家刘群说。 “如果我们能找到抑制剂,病毒就不会造成那么大的伤害。这可能会让健康状况不佳的人有更好的机会让他们的免疫系统成功抵抗病毒。”
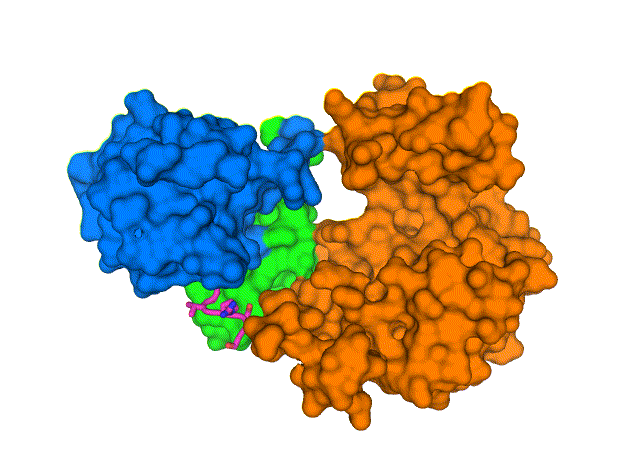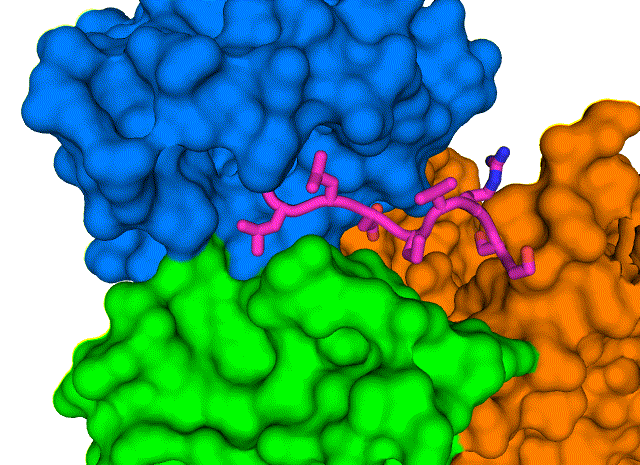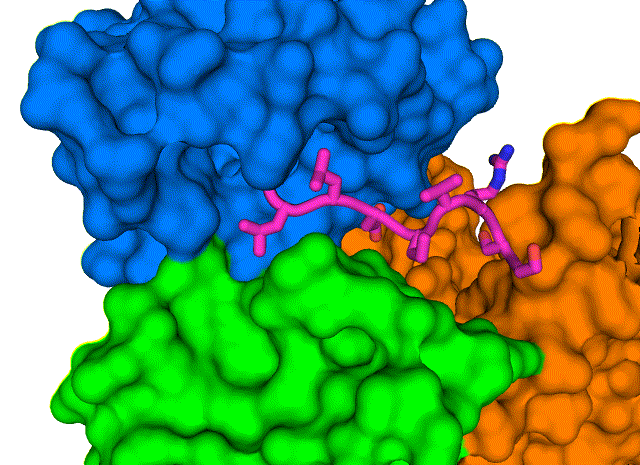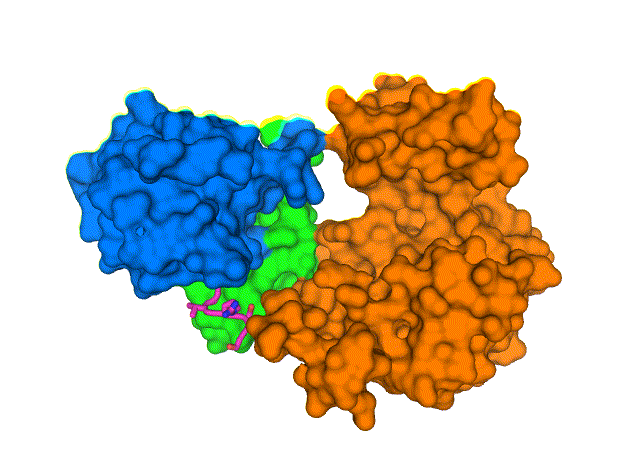
新结构显示了 COVID-19 病毒包膜蛋白(E,紫色棒)如何与人类细胞连接蛋白(PALS1,蓝色、绿色和橙色表面)相互作用。 了解这种复杂的结构,在布鲁克海文国家实验室用低温电子显微镜解析,可能会导致发现阻断相互作用的药物,并可能导致 COVID-19 最严重的影响。 图片来源:布鲁克海文国家实验室
科学家们使用布鲁克海文实验室生物分子结构 (LBMS) 实验室的一台新型低温电子显微镜发现了细节并开发了分子模型,这是一个由纽约州资助建造的新研究设施,毗邻布鲁克海文国家同步加速器光源 II (NSLS) -II.
LBMS 主任兼该论文的合著者 Sean McSweeney 说:“由于 LBMS 在对抗 COVID-19 中的重要性,LBMS 于去年夏天提前开放。LBMS 和 NSLS-II 提供互补的蛋白质成像技术,两者都发挥着重要作用。在破译 COVID-19 中涉及的蛋白质细节方面的作用。 这是根据新设施的调查结果发表的第一篇论文。”
LBMS 科学运营总监、该论文的另一位合著者 Liguo Wang 解释说:“冷冻电子显微镜 (cryo-EM) 对于研究跨膜蛋白质和动态蛋白质复合物特别有用,这些蛋白质可能难以在蛋白质中结晶。晶体学作为研究蛋白质结构的常用技术。使用这项技术,我们创建了一个 3D 地图,我们可以在其中看到单个蛋白质成分是如何组合在一起的。”
“如果没有冷冻电镜,我们就无法获得捕捉这些蛋白质之间动态相互作用的结构,”刘说。
刺激性肺病
SARS-CoV-2 包膜蛋白 (E) 与现在臭名昭著的病毒刺突蛋白一起位于病毒的外膜上,有助于在受感染的细胞内组装新的病毒颗粒。 在 COVID-19 大流行早期发表的研究表明,它在劫持人类蛋白质以促进病毒释放和传播方面也发挥着重要作用。 科学家们假设它通过与人体细胞之间的连接蛋白结合来实现这一点,使它们远离保持肺细胞之间紧密连接的通常工作。
“这种相互作用可能对病毒有益,但对人类非常不利——尤其是患有 COVID-19 的老年患者和那些有既往疾病的患者,”刘说。
当肺细胞连接出现故障时,免疫细胞进入并试图修复损伤,释放称为细胞因子的小蛋白质。 这种免疫反应会导致大规模炎症,导致所谓的“细胞因子风暴”和随后的 ARDS,从而使情况变得更糟。
此外,由于损伤会损害细胞与细胞之间的连接,因此病毒可能更容易从肺部逃逸并通过血流感染其他器官,包括肝脏、肾脏和血管。
“在这种情况下,大部分损害将发生在携带更多病毒和产生更多负电蛋白的患者身上,”刘说。 这可能会变成一个恶性循环:更多的病毒产生更多的 E 蛋白和更多的细胞导体蛋白被拉下,造成更多的损害、更多的运输,以及更多的病毒。 此外,任何存在的损伤,例如肺细胞的疤痕,都可能使 COVID 患者难以从损伤中恢复。
“这就是我们想要研究这种相互作用的原因——了解 E 如何与这些人类蛋白质之一相互作用的原子级细节,以了解如何中断相互作用并减少或防止这些极端影响,”刘说。
从点到点到映射到模型
科学家们通过将两种蛋白质混合在一起,快速冷冻样品,然后用冷冻电镜研究冷冻样品,获得了 E 和一种称为 PALS1 的人肺细胞连接蛋白之间相互作用的原子级细节。 电子显微镜使用高能电子与样品相互作用,就像普通光学显微镜使用光束一样。 但是电子由于其极短的波长(比可见光短 100,000 倍),让科学家能够在更小的尺度上看到事物。
第一张照片看起来只不过是斑点。 但是图像处理技术使该团队能够选择作为两种蛋白质实际复合物的补丁。
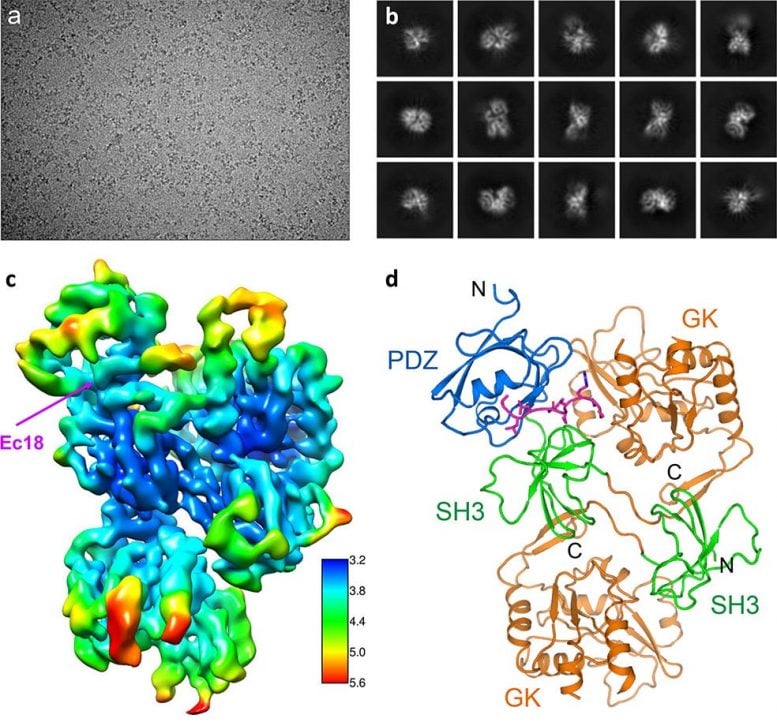
破译人类 PALS1 相关 COVID-19 病毒蛋白的结构:从颗粒纳米点的运动校正显微镜(a)开始,图像处理和 2D 平均从不同方向产生结合蛋白的低分辨率投影(b)。 然后计算工具将这些 2D 图像转换为 3D 地图 (c)。 蓝色表示精度更高、更稳定的部件,红色表示精度更低、更灵活的部件。 该图提供了足够的细节以将两种蛋白质的氨基酸构建块拟合到复合物 (d) 的最终结构中,其中 PALS1 的不同部分以蓝色、绿色和橙色显示,病毒蛋白 E 为洋红色。 图片来源:布鲁克海文国家实验室
我们已经使用了 2D 平均值,并且开始看到这些粒子的一些共同结构特征。 我们的图像显示了来自不同方向的复合材料,但分辨率相当低,”刘说。“然后我们使用布鲁克海文计算科学计划的计算工具和计算基础设施进行 3D 重建。这些为我们提供了一个 3D 模型——一张实验地图的结构。”
该地图的总分辨率为 3.65 埃(几个原子的大小),包含有关个人独特特征的足够信息。 氨基酸 它们构成了科学家们在地图中拟合这些氨基酸的已知结构的两种蛋白质。
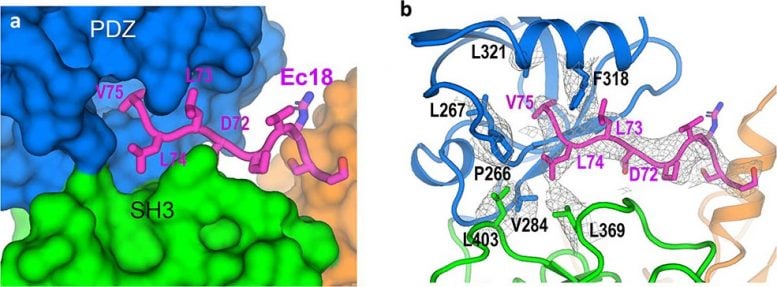
“我们可以看到构成 PALS1 蛋白质的氨基酸链如何折叠形成三个结构成分或结构域,以及构成蛋白质 E 的较小氨基酸链如何装入这两个结构域之间的疏水口袋中,”刘说。
该模型提供了结构细节和对分子间作用力的理解,这些作用力允许受影响细胞深处的 E 蛋白将 PALS1 拉离细胞外边界的位置。
“我们现在可以解释相互作用如何从人类肺细胞连接处拉出 PALS1 并导致损伤,”刘说。
对药物和进化的影响
“这种结构为我们的计算科学同事提供了基础,可以进行对接研究和分子动力学模拟,以寻找可能抑制相互作用的药物或类药物分子,”布鲁克海文实验室生物学主任、该研究的作者之一约翰山克林说。这本书。 纸。 “如果他们确定了有希望的线索,我们就有分析能力快速筛选这些候选药物,以确定可能对预防 COVID-19 严重后果至关重要的药物。”
了解这种蛋白质相互作用的动态还将帮助科学家追踪 SARS-CoV-2 等病毒是如何进化的。
当病毒蛋白 PALS1 从细胞连接处被拉出时,它可以帮助病毒更容易传播。 这将为病毒提供选择性优势。 刘说,任何增加病毒存活、传播或释放的特征都可能被保留。
病毒继续传播的时间越长,出现新的进化优势的机会就越大。
“这是应该确定和实施有前景的治疗方法的另一个原因,”刘说。 “除了预防严重感染外,有效治疗 COVID-19 的药物将使我们领先于这些突变。”
参考:2021 年 6 月 8 日, 自然联系.
DOI:10.1038 / s41467-021-23533-x
这项研究由布鲁克海文国家实验室的 COVID-19 研究与发展基金 (LDRD) 资助。 LBMS 由能源部科学局 (BER) 提供支持,NSLS-II 是美国能源部科学局用户设施,由科学局 (BES) 提供支持。

“创作者。屡获殊荣的问题解决者。音乐布道者。无法治愈的内向。”





More Stories
詹姆斯·韦伯太空望远镜检测到超大质量黑洞附近的冲击(图片)
研究表明,富含水果和蔬菜的饮食可以降低患心脏病和肾脏疾病的风险
中国的巨大陨石坑里有“天堂”森林,其中的植物适应了严酷的地下生活